Урок химии на тему "электролитическая диссоциация". Механизм электролитической диссоциации Механизм электрической диссоциации кислот
Читайте также
Все вещества по способности в растворе или в расплавленном состоянии проводить электрический ток можно подразделить на две группы: электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся кислоты, основания и соли.
Неэлектролитами называются вещества, растворы или расплавы которых электрический ток не проводят. Например, многие органические вещества.
Способность электролитов (проводников II рода) проводить электрический ток принципиально отличается от электропроводности металлов (проводников I рода): электропроводность металлов обусловлена движением электронов, а электропроводность электролитов связана с движением ионов.
Было обнаружено, что в растворах кислот, оснований и солей экспериментально найденные значения p, tкрист., tкип., pосм, больше теоретически рассчитанных для того же раствора по его молярной концентрации в i раз (i - изотонический коэффициент). Причем число частиц в растворе NaCl увеличилось почти в 2 раза, а в растворе СаCl2 - в 3 раза.
Для объяснения особенностей поведения электролитов шведским ученым С.Аррениусом в 1887 г. была предложена теория, получившая название теории электролитической диссоциации . Сущность теории состоит в следующем:
- 1. Электролиты при растворении в воде распадаются (диссоциируют) на заряженные частицы (ионы) - положительно заряженные катионы (Na+, K+, Ca2+, H+) и отрицательно заряженные анионы (Cl-, SO42-, CO32-, OH-). Свойства ионов совершенно иные, чем у образовавших их атомов. Распад нейтрального вещества на ионы в результате химического взаимодействия с растворителем называют электролитической диссоциацией.
- 2. Под действием электрического тока ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы - к положительно заряженному электроду (аноду).
- 3. Диссоциация - процесс обратимый и равновесный. Это означает, что параллельно с распадом молекул на ионы (диссоциация), идет процесс соединения ионов в молекулы (ассоциация): КА К+ + А-.
- 4. В растворе ионы находятся в гидратированном состоянии.
Для количественной оценки электролитической диссоциации используется понятие степени электролитической диссоциации () - отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул. Степень диссоциации определяется опытным путем и выражается в долях или процентах. Степень электролитической диссоциации зависит от природы растворителя и растворяемого вещества, температуры и концентрации раствора:
- 1. Чем более полярен растворитель, тем выше степень диссоциации в нем электролита.
- 2. Диссоциации подвергаются вещества с ионной и ковалентной полярной связью.
- 3. Повышение температуры, увеличивает диссоциацию слабых электролитов.
- 4. При уменьшении концентрации электролита (при разбавлении) степень диссоциации увеличивается.
В зависимости от величины степени диссоциация условно электролиты (при концентрации их растворов 0,1 М) делят на:
По виду образующихся при диссоциации ионов все электролиты можно разделить на кислоты, основания, соли.
Кислоты - электролиты, диссоциирующие с образованием только катионов H+ и кислотного остатка (Cl- - хлорид, NO3- - нитрат, SO42- - сульфат, HCO3 гидрокарбонат, CO32 карбонат). Например: НСl Н++Сl-, H2SO4 2Н++SO42- .
Наличие в растворах кислот иона водорода, точнее, гидратированного иона Н3O+, обусловливает общие свойства кислот (кислый вкус, действие на индикаторы, взаимодействие со щелочами, взаимодействие с металлами с выделением водорода и пр.).
В многоосновных кислотах диссоциация происходит ступенчато, причем каждая ступень характеризуется своей величиной степени диссоциации. Так, ортофосфорная кислота диссоциирует по трем ступеням:
|
I ступень |
H3РO4 Н+ + H2РO4- |
|
|
II ступень |
H2РO4- Н+ + HРO42- |
|
|
III ступень |
HРO42- Н+ + РO43- |
Причем 3<2<1, т.е. распад электролита на ионы протекает, в основном, по первой ступени и в растворе ортофосфорной кислоты будут находиться преимущественно ионы Н+ и H2РO4-. Причины этого в том, что ионы водорода значительно сильнее притягиваются к трехзарядному иону РO43- и двухзарядному иону HРO42-, чем к однозарядному H2РO4-. Кроме того, на 2-ой и 3-ей ступенях имеет место смещение равновесия в сторону исходной формы по принципу Ле-Шателье за счет накапливающихся ионов водорода.
Основания - электролиты, диссоциирующие с образованием в качестве анионов только гидроксид-ионы (OH-). После отрыва OH- остаются катионы: Na+, Cа2+, NH4+. Например: NaOH Na+ + ОН-, Са(ОН)2 Са2+ + 2 OН-.
Общие свойства оснований (мыльность на ощупь, действие на индикатор, взаимодействие с кислотами и пр.) определяются наличием в растворах оснований гидроксо-группы ОН-.
Для многокислотных оснований характерна ступенчатая диссоциация:
|
I ступень |
Ва(ОН)2 Ва(ОН)+ + OН- |
|
II ступень |
Ва(ОН)+ Ва2+ + OН- |
Диссоциация амфотерных гидроксидов протекает как по типу основания, так и по типу кислоты. Так, диссоциация гидроксида цинка может протекать по следующим направлениям (при этом равновесие сдвигается в зависимости от среды по принципу Ле-Шателье):
Соли - это электролиты, диссоциирующие на катионы металла (или заменяющих его групп) и анионы кислотного остатка.
Средние соли диссоциируют полностью: CuSO4 Cu2+ + SO42-. В отличие от средних солей, кислые и основные соли диссоциируют ступенчато:
|
I ступень |
NaНСО3 Na+ + НСО3- |
Сu(ОН)Cl Сu(ОН)+ + Cl- |
|
II ступень |
НСО3- Н+ + СО32- |
Сu(ОН)+ Сu2+ + OН-, |
причем степень диссоциации солей по второй ступени очень мала.
Реакции обмена в растворах электролитов - это реакции между ионами. Необходимым условием протекания реакций обмена в растворах электролитов является образование слабодиссоциирующих соединений или соединений, выделяющихся из раствора в виде осадка или газа.
При написании уравнений реакций в ионно-молекулярном виде слабодиссоциирующие, газообразные и труднорастворимые соединения записывают в виде молекул , а растворимые сильные электролиты - в виде ионов. При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде (Приложение А).
Рассмотрим методику написания ионных уравнений на примерах.
Пример 1. Напишите в ионно-молекулярной форме уравнение реакции:
ВаСl2 + K2SО4 = ВаSО4 + 2KСl
Решение: Соли являются сильными электролитами и практически полностью диссоциируют на ионы. Так как ВаSО4 - практически нерастворимое соединение (см. таблицу приложения А), основная часть сульфата бария будет находиться в недиссоциированном виде, поэтому это вещество запишем в виде молекул, а остальные соли, являющиеся растворимыми, в виде ионов:
Ва2+ + 2Сl- + 2K+ + SО42- = ВаSО4 + 2K+ + 2Сl-
Как видно из полученного полного ионно-молекулярного уравнения, ионы K+ и Сl- не взаимодействуют, поэтому, исключив их, получим краткое ионно-молекулярное уравнение:
Ва2+ + SО42- = ВаSО4 ,
Стрелка показывает, что образующееся вещество выпадает в осадок.
Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. Причем суть любой химической реакции отображает именно краткое ионно-молекулярное уравнение. На основании ионно-молекулярного уравнения можно легко написать молекулярное.
Пример 2. Подберите молекулярное уравнение к следующему ионно-молекулярному уравнению: 2Н+ + S2- = Н2S.
Решение: Ионы водорода образуются при диссоциации любой сильной кислоты, например НСl. К ионам водорода в кратком ионном уравнении необходимо добавить два иона хлора. К сульфид-ионам следует добавить катионы (например, 2K+), образующие растворимый, хорошо диссоциирующий электролит. Затем такие же ионы нужно написать в правой части. Тогда полное ионно-молекулярное и молекулярное уравнения будут иметь вид:
- 2Н+ + 2Сl- + 2K+ + S2- = Н2S + 2K+ + 2Сl-
- 2 НСl + K2S = Н2S + 2 KСl-
Цели: сформировать понятия об электролитах и неэлектролитах, ЭД, раскрыть механизм диссоциации веществ с ионной и ковалентной полярной связью, ввести понятие «степень электролитической диссоциации» и показать ее зависимости от различных факторов; сформулировать основные положения ТЭД; формировать умения у обучающихся составлять уравнения диссоциации;
развивать умения сравнивать, анализировать и делать выводы, навыки само– и взаимоконтроля, интеллектуальные способности;
воспитывать компетентную личность с практической направленностью.
Оборудование: компьютер, мультимедийный проектор, экран, прибор для определения электропроводности растворов, штативы с лапкой и кольцом, модель-аппликация «Механизм ЭД»
Реактивы: Н 2 О дист., NaCl кр., NaOH кр., ледяная уксусная кислота CH 3 COOH, С 12 Н 22 О 11 кр.; р-р Н 2 SO 4 , на каждую парту: растворы индикаторов метилоранжа, фенолфталеина, р-ры HCl, NaОН, Na 2 SO 4.
Ход урока
I. Организационный момент
II. Сообщение темы, постановка цели. Рефлексия
(Запись в тетрадь темы урока)
Учитель: Речь пойдет о самом удивительном веществе нашей планеты, без которого нет жизни – это воде, её роли при растворении веществ.
Прежде чем начать изучение новой темы, я хочу проверить ваше настроение. Зарисуйте свое настроение в индивидуальном сопроводительном листе, который находится у Вас на парте. (Приложение 1)
III. Изучение нового материала
1 этап. Электролиты, неэлектролиты.
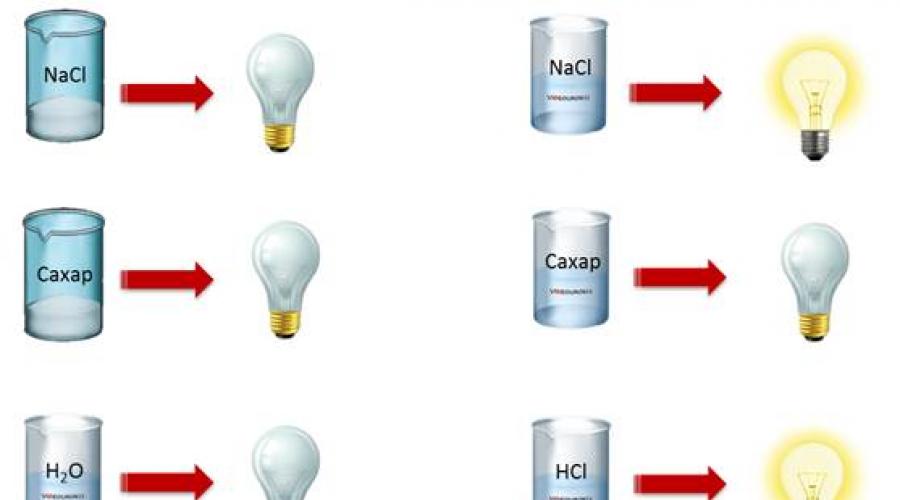
Учитель: Обратимся к истории 1837 года. В этот период в Лондоне в лаборатории Королевского института работали два учёных: Гемфри Деви и Майкл Фарадей. Они начали исследования в области электричества и ввели понятия, которыми мы пользуемся до сих пор. Деви и Фарадей проводили опыты по определению электропроводности растворов, используя специальный прибор, модель которого представлена у Вас на рис. 126 с.193 (О.С.Габриелян, Химия 8). Он состоит из 2-х электродов, лампочки и розетки. При опускании электродов в исследуемое вещество, если оно проводит ток, то лампочка загорается, если не проводит – не загорается.
Давайте и мы проведем исследования (Демонстрация электрической проводимости различных веществ с помощью специального прибора).
Беседа с классом:
– Предварительно вспомним, на какие 2 группы делят все химические соединения по типу химической связи?
Результаты эксперимента отмечаем в таблице сопроводительного листа. (Приложение 1)
Проверка электропроводности воды прибором
Беседа:
– Как Вы думаете, проводит вода электрический ток?
– Какой тип химической связи у воды? (Ковалентная слабо полярная
)
– К какому классу химических соединений она относится?
– Проверим электропроводность прибором. (Не проводит ток).
(Отмечаем в таблице. )
Проверка электропроводности у поваренной соли NaCl кристаллической.
– Какой тип химической связи у этого соединения?
– К какому классу оно относится?
– Как вы думаете, проводит NaClкр. электрический ток?
– Проверим прибором (Нет)
.
– А теперь добавим воду в соль и проверим электропроводность этого раствора.
– Как Вы думаете, будет раствор поваренной соли проводить электрический ток?
(Этот опыт может проделать ученик)
– Как Вы думаете почему?
На этот вопрос мы дадим ответ немного позже.
А сейчас продолжим исследование. И так далее….
– Какой вывод мы можем сделать на основе проведенных исследований?
(Вывод: Одни вещества проводят ток, а другие нет)
Учитель: Вещества, растворы которых проводят электрический ток назвали электролитами, а вещества, которые не проводят ток – неэлектролитами
– А какие вещества проводят электрический ток? (Растворы кислот,
щелочей, солей.
)
– С каким видом химической связи растворы веществ проводят электрический ток?
(Ионной, ковалентной сильно полярной)
– Какие вещества не проводят электрический ток? (Все кристаллические
вещества, оксиды, газы)
–
С каким видом химической связи вещества не проводят электрический ток?
(С ковалентной неполярной и слабо полярной)
Закрепление этапа 1: Задание 1 . Блиц-опрос :
– Сформулируйте определения электролитов и неэлектролитов. (Запись в
тетрадь
)
– Какой тип химической связи характерен электролитам и неэлектролитам?
– Классы каких веществ относятся к электролитам и неэлектролитам?
– Где Вы в жизни встречались с электролитами? (Аккумуляторы в автомобилях)
Задание 2. Выберите из перечня веществ электролиты и неэлектролиты, определив вид химической связи. Ответ поясните.
2 этап: Механизм электролитической диссоциации .
Продолжение беседы:
– Какие частицы могут создавать электрический ток в растворе? (Движущие
заряженные частицы)
– Почему и при каких условиях вещества проводят электрический ток?
(Они распадаются на ионы при растворении или расплавлении, являются проводниками второго рода. Прохождение тока происходит за счёт переноса ионов, а не электронов. Металлы – проводники первого рода (ток создается за счет свободных электронов).
– А какие заряженные частицы могут быть в растворах, например, у веществ с ионной связью – растворе NaCl? (Свободные ионы)
Внимание: В кристаллах ионы не свободные, а находятся в узлах кристаллической решетки.
– Что же происходит с кристаллом при растворении его в воде?
– Какова роль воды в этом процессе?
(Вода взаимодействует с электролитом и он под действием воды распадается на ионы).
Рассмотрим механизм этого процесса.
Сначала рассмотрим строение молекулы воды
Вода (диполь) < 104,5 0
Сообщение: Интересное о воде… (Приложение 3)
Механизм электролитической диссоциации с ионной связью на примере NaCl
Рассмотрите схему процесса (рис.127, с.195, Химия, 9, О.С.Габриелян).
– Что происходит с диполями воды?
Этот процесс называется ориентация . (Запись в тетрадь)
гидратация . (Запись в тетрадь)
3.Во время гидратации возникают силы взаимного притяжения между диполями и ионами, химическая связь между ионами кристалла ослабевает и ионы, окруженные «водным одеялом» отрываются и переходят в раствор.
Происходит распад – диссоциация .
Ионы, окруженные водной оболочкой, называют гидратированными .
Процесс диссоциации упрощенно можно записать: NaCl = Na + + Cl -
(Катионы, анионы)
– Они простые или сложные? (Простые)
– Итак, какие 3 процесса происходят при растворении веществ с ионной связью в воде?
1. ориентация
2. гидратация
3. диссоциация. Демонстрация процесса диссоциации. (Анимация
)
Задание для учащихся
С помощью модели-аппликации покажите на магнитной доске механизм диссоциации электролита с ионной связью и прокомментируйте это
Механизм электролитической диссоциации веществ с ковалентной полярной связью на примере НCl
– А каков механизм диссоциации электролита с ковалентной полярной связью?
– Рассмотрите схему процесса (рис.128, с.196, в учебнике).
– Что происходит с диполями воды?
1. Диполи ориентируются отрицательными концами вокруг положительных ионов, а положительными вокруг отрицательных.
Этот процесс называется ориентация . (Запись в тетрадь)
2. Между ионами электролита и диполями происходит взаимодействие. Этот процесс называется гидратация . (Запись в тетрадь)
3.Под действием диполей воды происходит превращение ковалентной полярной связи в ионную, то есть происходит ионизация молекул электролита.
4. Происходит распад – диссоциация .
Процесс диссоциации упрощенно можно записать: НCl = Н + + Cl -
– Как называют распавшиеся ионы?
– Они простые или сложные?
– Итак, какие процессы происходят при растворении веществ с ковалентной полярной
связью в воде?
1. ориентация
2. гидратация
3. ионизация
4. диссоциация
Демонстрация процесса диссоциации. (Анимация )
Задание для учащихся
С помощью модели-аппликации покажите на магнитной доске механизм диссоциации электролита с ковалентной полярной связью и прокомментируйте это
Вывод: при растворении в воде вещества взаимодействуют с диполями, распадаются на свободные гидратированные ионы и проводят электрический ток. Гидратация ионов является основной причиной диссоциации электролита.
К такому выводу пришел шведский ученый Сванте Аррениус в 1887 году.
Вернемся к истории.
Учитель: Так как диссоциация происходит у электролитов, поэтому ее называют электролитической.
Оказывается электролитами являются не только растворы кислот, солей и щелочей, но и их расплавы.
Давайте сформулируем определение ЭД.
По лесенке поднимемся к вершине горы, теме сегодняшнего урока.
– Какие ключевые слова мы применяли при исследованиях, выводах?
Что происходит с веществом при диссоциации? «распад»
– Какое вещество распадается? «электролит»
– На какие частицы распадается электролит? «ионы»
–
При каких условиях распадается? «при растворении в роде или
расплавлении»
– Повторим!!!
Процесс обратный диссоциации называется ассоциацией.
– Какиебывают ионы? Заполните схему:
И выполните задание.
– Отличаются ли ионы от атомов или молекул? Если да, то чем?
3 этап: Степень диссоциации. Сильные и слабые электролиты.
Учитель: Все ли электролиты в одинаковой степени проводят электрический ток? (Нет)
– Продолжим исследование с уксусной кислотой.
Демонстрация опыта:
Учитель: Проверим электропроводность концентрированной уксусной кислоты.
Беседа с классом:
– Что вы наблюдаете? (Лампочка горит очень слабо)
Вывод: не все электролиты в одинаковой степени проводят электрический ток. Бывают сильные и слабые электролиты.
Характеристикой силы электролита является степень диссоциации и обозначается α. α можно вычислить по формуле.
Для слабых электролитов процесс диссоциации обратим. HNO 2 ↔ H + + NO 2 -
Подробная информационная карта у вас на столах в сопроводительном листе.
– А можно ли «слабого сделать сильным», то есть увеличить степень диссоциации?
– От чего зависит α?
Продолжим исследования (Демонстрация опыта)
Беседа с классом:
1. Нагреем уксусную кислоту.
– Что Вы наблюдаете? От чего же зависит α?
2. Разбавим кислоту водой, то есть уменьшим её концентрацию.
– Что наблюдаете? От чего еще зависит α?
Вывод: α зависит от t, C. Если температуру увеличить α тоже увеличивается, если концентрацию увеличить α уменьшается.
4 этап: Кислоты, основания соли с точки зрения ЭД.
Учитель: Рассмотрим наглядно диссоциацию кислот, оснований и солей и составим уравнения их диссоциации на примере модельных схем ЭД кислот, щелочей и солей
Работа и беседа учителя с классом:
– Составьте алгоритм написания данных уравнений (по образцу).
–
На какие ионы диссоциируют кислоты?
– Сформулируйте определение кислот с точки зрения ЭД. -Каким ионом будут
определяться их свойства?
– Докажите экспериментально, что у вас в пробирке №1 кислота.(Обучающиеся
выполняют
лабораторный опыт)
– На какие ионы диссоциируют основания?
– Сформулируйте определение оснований с точки зрения ЭД.
– Каким ионом будут определяться их свойства?
– Докажите экспериментально, что у вас в пробирке №2 щелочь.
(Обучающиеся выполняют лабораторный опыт)
– На какие ионы диссоциируют соли?
– Сформулируйте определение солей с точки зрения ЭД.
– Каким ионом будут определяться их свойства? (Разными)
5 этап: Физкультминутка для глаз
А теперь все отдохнем
Глазки крепенько сожмем
Поморгаем раз пяток
И продолжим наш урок
Крепко глазки зажмурим
Вспомним всё и повторим:
Раз, да, три, четыре, пять
Вернемся к диссоциации опять.
Истина всегда проста:
Щелочь, соль и кислота
Пропускают ток всегда,
Если их раствор – вода.Почему же кислород,
Спирт, глюкоза и азот,
Растворенные в воде,
Не пропустят ток нигде?Потому что вещества –
Неживые существа,
И зависят свойства их,
Сложных и совсем простых,
От строения частиц,
Микромира без границ.
А раствор, где ток бурлит,
Назван был электролит
Укрепляя мышцы глаз,
Взгляд меняем 8 раз
То поближе, то подальше
Посмотреть прошу я Вас.
От усталости спасет
Вас глазной круговорот.
Круга 3 вращайте влево,
А потом наоборот!
IV. Закрепление
1. Задания в игровой форме, проблемно-поисковые задания на слайдах.
2. Самостоятельная работа на 10 мин (Слайд
)
V. Обобщающие выводы
Учитель: Все сегодняшние полученные знания можно обобщить в одной теории, которая называется теорией электролитической диссоциации (ТЭД)
Основные положения сформулированы в опорном конспекте (Приложение 4 ).
Работа с опорным конспектом
- Все вещества делятся на электролиты и неэлектролиты. ТЭД изучает электролиты.
- При растворении в воде эл-ты диссоциируют на ионы.
- Причина диссоциации – гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
- Под действием эл. тока + ионы(катионы) движутся к катоду, а отрицательные (анионы) к аноду.
- ЭД обратима для слабых электролитов.
- Не все электролиты в одинаковой степени диссоциируют на ионы. Поэтому они делятся на сильные и слабые и характеризуются степенью диссоциации, которая зависит от разных причин.
- Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
- По характеру образующихся ионов различают 3 типа электролитов.
VI. Подведение итога урока. Домашнее задание
§35,36; упр. № 4,5 с.203,
Индивидуальные доп.зад. в раб. тетр. №18, с.124, №20 с.126
Учитель: Прежде чем закончить урок, я хочу проверить ваше настроение в конце урока. Зарисуйте свое настроение в индивидуальном сопроводительном листе, который находится у Вас на парте. (Приложение 1)
Заключение
Ты – молодчина! И в это поверь.
Открыта тобой в мир химии дверь.
Надеемся все мы, что лет через пять,
Прекрасным ученым сможешь ты стать.
Проводимость веществами электрического тока или отсутствие проводимости можно наблюдать с помощью простого прибора.
Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара,то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли.
К неэлектролитам относятся большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Электролиты - проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Очевидно, чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Различают сильные и слабые электролиты.
Сильные электролиты при растворении вводе полностью диссоциируют на ионы.
К ним относятся:
1) почти все соли;
2) многие минеральные кислоты, например Н 2 SO 4 , HNO 3 , НСl, HBr, HI, НМnО 4 , НСlО 3 , НСlО 4 ;
3) основания щелочных и щелочноземельных металлов.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
К ним относятся:
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например H 2 СО 3 , Н 2 S, НNO 2 , HClO, H 2 SiO 3 ;
3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH 4 OH, который можно изображать как гидрат аммиака NH 3 ∙H 2 O.
К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Основные положения теории электролитической диссоциации.
Распад электролитов на ионы при растворении их в воде называется элекролитической диссоциацией.
Так, хлорид натрия NaСl при растворении в воде полностью распадается на ионы натрия Na + и хлорид-ионы Cl - .
Вода образует ионы водорода Н + и гидроксид-ионы ОН - лишь в очень незначительных количествах.
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы - положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома - это простые ионы (Na + , Mg 2+ , Аl 3+ и т.д.) - или из нескольких атомов - это сложные ионы (NО 3 - , SO 2- 4 , РО З- 4 и т.д.).
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами.
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К + и анион А - в общем виде записывается так:
КА ↔ K + + A -
Теория электролитической диссоциации является одной из основных теорий в неорганической химии и полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Степень диссоциации.
Одним из важнейших понятий теории электролитической диссоциации Аррениуса является понятие о степени диссоциации.
Степенью диссоциации (а) называется отношение числа молекул, распавшихся на ионы (n"), к общему числу растворенных молекул (n):
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило, увеличивает степень диссоциации и повышение температуры. По степени диссоциации электролиты делят на сильные и слабые.
Рассмотрим смещение равновесия, устанавливающегося между недиссоциированными молекулами и ионами при электролитической диссоциации слабого электролита - уксусной кислоты:
СН 3 СООН ↔ СН 3 СОO - + Н +
При разбавлении раствора уксусной кислоты водой равновесие сместится в сторону образования ионов, - степень диссоциации кислоты возрастает. Наоборот, при упаривании раствора равновесие смещается в сторону образования молекул кислоты - степень диссоциации уменьшается.
Из этого выражения очевидно, что α может изменяться от 0 (диссоциации нет) до 1 (полная диссоциация). Степень диссоциации часто выражают в процентах. Степень диссоциации электролита может быть определена только экспериментальным путем, например по измерению температуры замерзания раствора, по электропроводности раствора и т. д.
Механизм диссоциации
Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами - к отрицательному полюсу. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гидратированные ионы:

Диссоциация полярных молекул может быть полной или частичной.
Таким образом, электролитами являются соединения с ионной или полярной связью - соли, кислоты и основания. И диссоциировать на ионы они могут в полярных растворителях.
Константа диссоциации.
Константа диссоциации. Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
A K → A - + K + .
Поскольку диссоциация является обратимым равновесным процессом, то к этой реакции применим закон действующих масс, и можно определить константу равновесия как:

где К - константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.
Диапазон констант равновесия для разных реакций очень большой - от 10 -16 до 10 15 . Например, высокое значение К для реакции
означает, что если в раствор, содержащий ионы серебра Ag + ,внести металлическую медь, то в момент достижения равновесия концентрация ионов меди намного больше, чем квадрат концентрации ионов серебра 2 . Напротив, низкое значение К в реакции
говорит о том, что к моменту достижения равновесия растворилось ничтожно малое количество иодида серебра AgI.
Обратите особое внимание на форму записи выражений для константы равновесия. Если концентрации некоторых реагентов существенно не изменяются в процессе реакции, то они не записываются в выражение для константы равновесия (такие константы обозначаются К 1).
Так, для реакции меди с серебром неправильным будет выражение:

Правильной будет следующая форма записи:

Это объясняется тем, что концентрации металлических меди и серебра введены в константу равновесия. Концентрации меди и серебра определяются их плотностью и не могут быть изменены. Поэтому эти концентрации нет смысла учитывать при расчете константы равновесия.
Аналогично объясняются выражения констант равновесия при растворении AgCl и AgI
Произведение растворимости. Константы диссоциации малорастворимых солей и гидроксидов металлов называются произведением растворимости соответствующих веществ (обозначается ПР).
Для реакции диссоциации воды
выражение константы будет:

Объясняется это тем, что концентрация воды во время реакций в водных растворах изменяется очень незначительно. Поэтому принимается, что концентрация [Н 2 О] остается постоянной и вводится в константу равновесия.
Кислоты, основания и соли с позиций электролитической диссоциации.
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
Например:
НCl ↔ Н + + С l - ;
СН 3 СООН ↔ Н + + СН 3 СОО -
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н 3 РО 4 имеются ионы (в последовательно уменьшающихся количествах) Н 2 РО 2- 4 , НРО 2- 4 и РО 3- 4
Н 3 РО 4 ↔ Н + + Н 2 РО - 4 (первая ступень)
Н 2 РО - 4 ↔ Н + + НРO 2- 4 (вторая ступень)
НРО 2- 4 ↔ Н+ PО З- 4 (третья ступень)
Основностъ кислоты определяется числом катионов водорода, которые образуются при диссоциации.
Так, НCl, HNO 3 - одноосновные кислоты - образуется один катион водорода;
Н 2 S, Н 2 СО 3 , Н 2 SO 4 - двухосновные,
Н 3 РО 4 , Н 3 АsО 4 - трехосновные, так как образуются соответственно два и три катиона водорода.
Из четырех атомов водорода, содержащихся в молекуле уксусной кислоты СН 3 СООН, только один, входящий в карбоксильную группу - СООН, способен отщепляться в виде катиона Н + , - уксусная кислота одноосновная.
Двух - и многоосновные кислоты диссоциируют ступенчато (постепенно).
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Например:
KOH ↔ K + + OH - ;
NH 4 OH ↔ NH + 4 + OH -
Основания,растворимые в воде называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН) 2 , Sr(ОН) 2 , Ва(ОН) 2 , Rа(ОН) 2 , а также NН 4 ОН. Большинство оснований в воде малорастворимо.
Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, NН 4 ОН - однокислотное основание, Са(ОН) 2 - двухкислотное, Fе(ОН) 3 - трехкислотное и т. д. Двух- и многокислотные основания диссоциируют ступенчато
Ca(ОН) 2 ↔ Са(ОН) + + OH - (первая ступень)
Ca(OH) + ↔ Ca 2+ + OH - (вторая ступень)
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид - ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н + и ОН - (в незначительных количествах):
Н 2 O ↔ Н + + ОН -
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода Н + , и щелочные свойства, обусловленные наличием ионов ОН - .
Диссоциацию амфотерного гидроксида цинка Zn(ОН) 2 можно выразить уравнением
2ОН - + Zn 2+ + 2Н 2 О ↔ Zn(ОН) 2 + 2Н 2 О ↔ 2- + 2Н +
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH 4) и анионы кислотных остатков
Например:
(NH 4) 2 SO 4 ↔ 2NH + 4 + SO 2- 4 ;
Na 3 PO 4 ↔ 3Na + + PO 3- 4
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
KHSO 4 ↔ K + + HSO - 4
HSO - 4 ↔ H + + SO 2- 4
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
Mg(OH)Cl ↔ Mg(OH) + + Cl -
Главная причина диссоциации – поляризационное взаимодействие полярных молекул растворителя с молекулами растворенного вещества.Например, молекула воды – полярна, ее дипольный момент μ = 1,84 D, т.е. она обладает сильным поляризующим действием. В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны два случая:
Рис. 4.8 Растворение вещества с ионной кристаллической решеткой
1. Растворенное вещество с ионной связью (NaCl, KCl и т.д.). Кристаллы таких веществ уже состоят из ионов. При их растворении полярные молекулы воды (диполи) будут ориентироваться к ионам своими противоположными концами. Между ионами и диполями воды возникают силы взаимного притяжения (ион-дипольное взаимодействие), в результате связь между ионами ослабевает, и они в гидратированном виде переходят в раствор (рис. 4.8). В рассматриваемом случае одновременно с растворением происходит диссоциация молекул. Вещества с ионной связью диссоциируют легче всего.
2. Растворенное вещество с полярной ковалентной связью (например, НCl, H 2 SO 4 , H 2 S и др.). Здесь также вокруг каждой полярной молекулы вещества ориентируются соответствующим образом диполи воды с образованием гидратов. В результате такого диполь-дипольного взаимодействия связующее электронное облако (электронная пара) практически полностью сместится к атому с большей электроотрицательностью, при этом полярная молекула превращается в ионную (стадия ионизации молекулы) и затем распадается на ионы, которые переходят в раствор в гидратированном виде (рис. 4.9). Диссоциация может быть полной или частичной – все зависит от степени полярности связей в молекуле.

ионизация диссоциация
Рис. 4.9 Растворение вещества с ковалентной полярной связью
Различие между рассмотренными случаями заключается в том, что в случае ионной связи ионы существовали в кристалле, а в случае полярной – они образуются в процессе растворения. Соединения, содержащие одновременно и ионные, и полярные связи, сначала диссоциируют по ионным, а затем по ковалентным полярным связям. Например, гидросульфат натрия NаНSО 4 полностью диссоциирует по связи Na-O, частично – по связи H-O и практически не диссоциирует по малополярным связям серы с кислородом.
Таким образом, при растворении диссоциируют только соединения с ионной и ковалентной полярной связью и только в полярных растворителях.
Степень диссоциации. Сильные и слабые электролиты
Количественной характеристикой электролитической диссоциации является степень диссоциации электролита в растворе. Эта характеристика была введена Аррениусом. Степень диссоциации – α - это отношение числа молекул N, распавшихся на ионы, к общему числу молекул растворенного электролита N 0:
α выражают в долях единицы или в %.
По степени диссоциации электролиты делят на сильные или слабые.
При растворении в воде сильные электролиты диссоциируют практически полностью, процесс диссоциации в них необратим. У сильных электролитов степень диссоциации в растворах равна единице (α=1) и почти не зависит от концентрации раствора.В уравнениях диссоциации сильных электролитов ставят знак “=” или “ ”. Например, уравнение диссоциации сильного электролита сульфата натрия имеет вид
Nа 2 SО 4 = 2Nа + + SО 4 2 - .
К сильным электролитам в водных растворах относятся почти все соли, основания щелочных и щелочноземельных металлов, кислоты: H 2 SO 4 , HNO 3 , HCl, HBr, HI, HСlO 4 , HClO 3 , HBrO 4 , HBrO 3 , HIO 3 , H 2 SeO 4 , HMnO 4 , H 2 MnO 4 и т.д.
К слабым электролитам относятся электролиты, степень диссоциации которых в растворах меньше единицы (α<1) и она уменьшается с ростом концентрации.
Процесс диссоциации слабых электролитов протекает обратимо до установления равновесия в системе между нераспавшимися молекулами растворенного вещества и его ионами. В уравнениях диссоциации слабых электролитов ставят знак «обратимости». Например, уравнение диссоциации слабого электролита гидроксида аммония имеет вид
NН 4 + ОН NН 4 + + ОН -
К слабым электролитам относят воду, почти все органические кислоты (муравьиную, уксусную, бензойную и т.д.), ряд неорганических кислот (H 2 SO 3 , HNO 2 , H 2 CO 3 , H 3 AsO 4 , H 3 AsO 3 , H 3 BO 3 , H 3 PO 4 , H 2 SiO 3 , H 2 S, H 2 Se, H 2 Te, HF, HCN, HCNS), основания p-, d-, f- элементов (Al(OH) 3 , Cu(OH) 2 , Fe(OH) 2 и т.д.), гидроксид аммония, гидроксиды магния и бериллия, некоторые соли (CdI 2 , CdCl 2 , HgCl 2 , Hg(CN) 2 , Fe(CNS) 3 и т.д.).
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% - средними, менее 3% - слабыми электролитами.
Численное значение степени электролитической диссоциации зависит от различных факторов:
1 . Природа растворителя.
Это связано с величиной диэлектрической проницаемости растворителя ε. Как следует из закона Кулона, сила электростатического притяжения двух разноименно заряженных частиц зависит не только от величины их зарядов, расстояния между ними, но и от природы среды, в которой взаимодействуют заряженные частицы, т.е. от ε:
Например, при 298 К ε(Н 2 О) = 78,25, а ε(С 6 Н 6) = 2,27. Такие соли, как KCl, LiCl, NaCl и др., в воде полностью диссоциированы на ионы, т.е. ведут себя как сильные электролиты; в бензоле эти соли диссоциируют лишь частично, т.е. являются слабыми электролитами. Таким образом, одни и те же вещества могут проявлять различную способность к диссоциации в зависимости от природы растворителя.
2 . Температура.
У сильных электролитов с повышением температуры степень диссоциации уменьшается, у слабых – при повышении температуры до 60°С α увеличивается, а затем начинает уменьшаться.
3 . Концентрация раствора.
Если рассматривать диссоциацию как равновесный химический процесс, то в соответствии с принципом Ле Шателье добавление растворителя (разбавление водой), как правило, увеличивает количество продиссоциированных молекул, что приводит к увеличению α. Процесс образования молекул из ионов в результате разбавления затрудняется: для образования молекулы должно произойти столкновение ионов, вероятность которого с разбавлением уменьшается.
4 . Наличие одноименных ионов.
Добавление одноименных ионов уменьшает степень диссоциации, что также согласуется с принципом Ле Шателье. Например, в растворе слабой азотистой кислоты при электролитической диссоциации устанавливается равновесие между недиссоциированными молекулами и ионами:
НNО 2 Н + + NО 2 - .
При введении в раствор азотистой кислоты нитрит-ионов NO 2 ˉ (прибавлением раствора нитрита калия КNО 2) равновесие сместится влево, следовательно, степень диссоциации α уменьшится. Аналогичный эффект даст и введение в раствор ионов Н + .
Необходимо отметить, что не следует путать понятия «сильный электролит» и «хорошая растворимость». Например, растворимость СН 3 СООН в Н 2 О неограниченная, однако уксусная кислота относится к слабым электролитам (α = 0,014 в 0,1 М растворе). С другой стороны, ВаSО 4 – малорастворимая соль (при 20°С растворимость меньше 1 мг в 100 г Н 2 О), но относится к сильным электролитам, так как все молекулы, перешедшие в раствор, распадаются на ионы Ва 2+ и SО 4 2 - .
Константа диссоциации
Более точной характеристикой диссоциации электролита является константа диссоциации , которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
AK A – + K + .
Поскольку диссоциация является обратимым равновесным процессом, то к этой реакцииприменим закон действующих масс, и можно определить константу равновесия как:
где К – константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.
Диапазон констант равновесия для разных реакций очень большой - от 10 –16 до 10 15 .
Диссоциация веществ, состоящих более чем из двух ионов, происходит ступенчато. Для реакции вида
A n K m nA – m + mK + n
константа диссоциации имеет вид
![]()
Например, сернистая кислота диссоциирует ступенчато:
H 2 SO 3 H + + HSO 3 –
HSO 3 – H + + SO 3 2–
Каждая ступень диссоциации описывается своей константой:
![]()
![]()
При этом видно, что
При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в меньшей степени, чем по предыдущей. Иначе говоря:
К д1 > К д2 >…
Если концентрация электролита, распадающегося на два иона равна С в , а степень его диссоциации равна α, то концентрация образующихся ионов составит С в α , а концентрация недиссоциированных молекул – С в (1–α) . Выражение для константы принимает следующий вид:
Это уравнение выражает закон разбавления Оствальда . Оно позволяет вычислять степень диссоциации при различных концентрациях электролита, если известна его константа диссоциации. Для слабых электролитов α<<1, тогда (1–α) → 1. Уравнение в этом случае принимает вид:
Это уравнение наглядно показывает, что степень диссоциации возрастает при разбавлении раствора .
В водных растворах сильные электролиты обычно полностью диссоциированы, поэтому число ионов в них больше, чем в растворах слабых электролитов той же концентрации. При этом силы межионного притяжения и отталкивания довольно велики. В таких растворах ионы не вполне свободны, движение их стеснено взаимным притяжением друг к другу. Благодаря этому притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получивших название «ионной атмосферы».